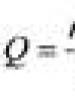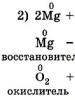واکنش های اکسیداسیون - احیا واکنش های ردوکس
بر این اساس، بین واکنش های ردوکس و واکنش هایی که بدون تغییر حالت های اکسیداسیون عناصر شیمیایی رخ می دهند، تمایز قائل می شوند.
اینها شامل بسیاری از واکنشها، از جمله همه واکنشهای جایگزینی، و همچنین آن دسته از واکنشهای ترکیبی و تجزیه میشوند که حداقل یک ماده ساده در آن دخالت دارد، برای مثال:

همانطور که به یاد دارید، ضرایب در واکنش های ردوکس پیچیده با استفاده از روش تعادل الکترونی محاسبه می شود:

در شیمی آلی، یک مثال بارز از واکنش های ردوکس، خواص آلدئیدها است.
1. آنها به الکل های مربوطه کاهش می یابد:

2. آلدهیدها به اسیدهای مربوطه اکسید می شوند:


ماهیت تمام نمونه های بالا از واکنش های ردوکس با استفاده از روش شناخته شده تعادل الکترونی ارائه شد. این مبتنی بر مقایسه حالت های اکسیداسیون اتم ها در واکنش دهنده ها و محصولات یک واکنش و متعادل کردن تعداد الکترون ها در فرآیندهای اکسیداسیون و احیا است. از این روش برای جمع آوری معادلات برای واکنش هایی که در هر فازی رخ می دهند استفاده می شود. این باعث می شود همه کاره و راحت باشد. اما در عین حال، یک اشکال جدی دارد - هنگام بیان ماهیت واکنش های ردوکس که در محلول ها رخ می دهد، ذراتی نشان داده می شود که واقعا وجود ندارند.
در این مورد، استفاده از روش دیگری - روش نیمه واکنش راحت تر است. این بر اساس گردآوری معادلات یون-الکترونیک برای فرآیندهای اکسیداسیون و احیا، با در نظر گرفتن ذرات واقعی موجود و جمع بعدی آنها در یک معادله کلی است. در این روش از مفهوم "حالت اکسیداسیون" استفاده نمی شود و محصولات با استخراج معادله واکنش تعیین می شوند.
بیایید این روش را با یک مثال نشان دهیم: اجازه دهید یک معادله برای واکنش ردوکس روی با اسید نیتریک غلیظ ایجاد کنیم.
1. ما طرح یونی فرآیند را می نویسیم که فقط شامل عامل کاهنده و محصول اکسیداسیون آن، عامل اکسید کننده و محصول احیای آن است:
2. معادله یون-الکترونیک فرآیند اکسیداسیون را می سازیم (این اولین نیمه واکنش است):
3. معادله یون-الکترونیک فرآیند کاهش را می سازیم (این نیمه واکنش دوم است):
لطفا توجه داشته باشید: معادلات الکترون یون مطابق با قانون بقای جرم و بار نوشته شده است.
4. معادلات نیمه واکنش را طوری می نویسیم که تعداد الکترون های بین عامل احیا کننده و عامل اکسید کننده متعادل شود:
5. اجازه دهید معادلات نیمه واکنش را ترم به ترم جمع کنیم. معادله یونی کلی واکنش را می سازیم:
صحت معادله واکنش را به صورت یونی بررسی می کنیم:
- حفظ برابری در تعداد اتم های عناصر و تعداد بارها
- تعداد اتم های عناصر باید در سمت چپ و راست معادله واکنش یونی برابر باشد.
- بار کل ذرات در سمت چپ و راست معادله یونی باید یکسان باشد.
6. معادله را به شکل مولکولی بنویسید. برای انجام این کار، تعداد مورد نیاز یون های بار مخالف را به یون های موجود در معادله یونی اضافه کنید:
واکنش هایی که بدون تغییر حالت اکسیداسیون عناصر شیمیایی رخ می دهد. اینها شامل، برای مثال، تمام واکنش های تبادل یونی، و همچنین بسیاری از واکنش های پیوستن، به عنوان مثال:
بسیاری از واکنش های تجزیه:
واکنش های استریفیکاسیون:
7.1. انواع اساسی واکنش های شیمیایی
دگرگونی مواد همراه با تغییر در ترکیب و خواص آنها، واکنش های شیمیایی یا فعل و انفعالات شیمیایی نامیده می شود. در طی واکنش های شیمیایی، هیچ تغییری در ترکیب هسته اتم ایجاد نمی شود.
به پدیده هایی که در آنها شکل یا حالت فیزیکی مواد تغییر می کند یا ترکیب هسته های اتم تغییر می کند، فیزیکی می گویند. نمونه ای از پدیده های فیزیکی، عملیات حرارتی فلزات است که در طی آن شکل آنها تغییر می کند (جعل)، ذوب شدن فلز، تصعید ید، تبدیل آب به یخ یا بخار و غیره و همچنین واکنش های هسته ای. در نتیجه اتم ها از اتم های برخی عناصر دیگر عناصر تشکیل می شوند.
پدیده های شیمیایی می توانند با دگرگونی های فیزیکی همراه باشند. به عنوان مثال، در نتیجه واکنش های شیمیایی در یک سلول گالوانیکی، جریان الکتریکی ایجاد می شود.
واکنش های شیمیایی بر اساس معیارهای مختلفی طبقه بندی می شوند.
1. با توجه به علامت اثر حرارتی، تمام واکنش ها به تقسیم می شوند گرماگیر(پیشرفت با جذب حرارت) و گرمازا(جریان با آزاد شدن گرما) (نگاه کنید به § 6.1).
2. بر اساس وضعیت تجمع مواد اولیه و محصولات واکنش، آنها متمایز می شوند:
واکنش های همگن، که در آن همه مواد در یک فاز هستند:
2 KOH (p-p) + H2 SO 4 (p-p) = K2 SO (p-p) + 2 H2O (l)،
CO (g) + Cl 2 (g) = COCl 2 (گرم)،
SiO 2 (k) + 2 Mg (k) = Si (k) + 2 MgO (k).
واکنش های ناهمگنموادی که در فازهای مختلف قرار دارند:
CaO (k) + CO 2 (g) = CaCO 3 (k)،
CuSO 4 (محلول) + 2 NaOH (محلول) = Cu(OH) 2 (k) + Na2 SO4 (محلول)،
Na 2 SO 3 (محلول) + 2HCl (محلول) = 2 NaCl (محلول) + SO 2 (g) + H 2 O (l).
3. با توجه به قابلیت جریان فقط در جهت جلو و همچنین در جهت جلو و عقب، آنها را تشخیص می دهند. غیر قابل برگشتو برگشت پذیرواکنش های شیمیایی (نگاه کنید به § 6.5).
4. بر اساس وجود یا عدم وجود کاتالیزورها، آنها را تشخیص می دهند کاتالیزوریو غیر کاتالیزوریواکنش ها (نگاه کنید به § 6.5).
5. با توجه به مکانیسم وقوع آنها، واکنش های شیمیایی به تقسیم می شوند یونی, افراطیو غیره (مکانیسم واکنش های شیمیایی که با مشارکت ترکیبات آلی رخ می دهد در درس شیمی آلی مورد بحث قرار می گیرد).
6. با توجه به حالت های اکسیداسیون اتم های موجود در ترکیب مواد واکنش دهنده، واکنش هایی رخ می دهد. بدون تغییر حالت اکسیداسیوناتم ها و با تغییر در حالت اکسیداسیون اتم ها ( واکنش های ردوکس) (به بند 7.2 مراجعه کنید).
7. واکنش ها با تغییر در ترکیب مواد اولیه و محصولات واکنش متمایز می شوند اتصال، تجزیه، جایگزینی و تبادل. این واکنش ها می تواند هم با و هم بدون تغییر در حالت اکسیداسیون عناصر رخ دهد . 7.1.
جدول 7.1
انواع واکنش های شیمیایی
طرح کلی |
نمونه هایی از واکنش هایی که بدون تغییر حالت اکسیداسیون عناصر رخ می دهند |
نمونه هایی از واکنش های ردوکس |
|
اتصالات (یک ماده جدید از دو یا چند ماده تشکیل می شود) |
HCl + NH 3 = NH 4 Cl; SO 3 + H 2 O = H 2 SO 4 |
H 2 + Cl 2 = 2HCl. 2Fe + 3Cl 2 = 2FeCl 3 |
|
تجزیه (چندین ماده جدید از یک ماده تشکیل می شود) |
A = B + C + D |
MgCO 3 MgO + CO 2; H 2 SiO 3 SiO 2 + H 2 O |
2AgNO 3 2Ag + 2NO 2 + O 2 |
تعویض ها (زمانی که مواد برهم کنش می کنند، اتم های یک ماده جایگزین اتم های ماده دیگر در یک مولکول می شوند) |
A + BC = AB + C |
CaCO 3 + SiO 2 CaSiO 3 + CO 2 |
Pb(NO 3) 2 + Zn = Mg + 2HCl = MgCl 2 + H 2 |
|
(دو ماده اجزای تشکیل دهنده خود را مبادله می کنند و دو ماده جدید تشکیل می دهند) |
AB + CD = AD + CB |
AlCl 3 + 3 NaOH = Ca(OH) 2 + 2HCl = CaCl 2 + 2H 2 O |
7.2. واکنش های ردوکس
همانطور که در بالا ذکر شد، تمام واکنش های شیمیایی به دو گروه تقسیم می شوند:
واکنش های شیمیایی که با تغییر در حالت اکسیداسیون اتم های سازنده واکنش دهنده ها رخ می دهد، واکنش های ردوکس نامیده می شود.
اکسیداسیونفرآیند واگذاری الکترون توسط یک اتم، مولکول یا یون است:
Na o – 1e = Na + ;
Fe 2+ – e = Fe 3+ ;
H 2 o – 2e = 2H + ;
2 Br – – 2e = Br 2 o.
بهبودفرآیند افزودن الکترون به یک اتم، مولکول یا یون است:
S o + 2e = S 2– ;
Cr 3+ + e = Cr 2+ ;
Cl 2 o + 2e = 2Cl – ;
Mn 7+ + 5e = Mn 2+ .
اتم ها، مولکول ها یا یون هایی که الکترون ها را می پذیرند نامیده می شوند عوامل اکسید کننده. مرمت کننده هااتم ها، مولکول ها یا یون هایی هستند که الکترون اهدا می کنند.
با پذیرش الکترون، عامل اکسید کننده در طی واکنش کاهش می یابد و عامل احیا کننده اکسید می شود. اکسیداسیون همیشه با کاهش همراه است و بالعکس. بدین ترتیب، تعداد الکترون هایی که عامل احیا کننده می دهد همیشه با تعداد الکترون های پذیرفته شده توسط عامل اکسید کننده برابر است..
7.2.1. حالت اکسیداسیون
حالت اکسیداسیون، بار مشروط (رسمی) یک اتم در یک ترکیب است که با این فرض محاسبه می شود که فقط از یون تشکیل شده است. حالت اکسیداسیون معمولاً با یک عدد عربی در بالای نماد عنصر با علامت "+" یا "-" نشان داده می شود. به عنوان مثال، Al 3+، S 2–.
برای یافتن حالت های اکسیداسیون، از قوانین زیر استفاده می شود:
حالت اکسیداسیون اتم ها در مواد ساده صفر است.
مجموع جبری حالت های اکسیداسیون اتم ها در یک مولکول برابر با صفر است، در یک یون پیچیده - بار یون.
حالت اکسیداسیون اتم های فلز قلیایی همیشه +1 است.
اتم هیدروژن در ترکیبات با غیر فلزات (CH 4، NH 3، و غیره) حالت اکسیداسیون +1 را نشان می دهد و با فلزات فعال حالت اکسیداسیون آن -1 است (NaH، CaH2، و غیره).
اتم فلوئور در ترکیبات همیشه حالت اکسیداسیون -1 را نشان می دهد.
حالت اکسیداسیون اتم اکسیژن در ترکیبات معمولاً 2- است، به جز پراکسیدها (H 2 O 2، Na 2 O 2) که در آنها حالت اکسیداسیون اکسیژن -1 است و برخی مواد دیگر (سوپراکسیدها، اوزونیدها، اکسیژن). فلوراید).
حداکثر حالت اکسیداسیون مثبت عناصر در یک گروه معمولاً برابر با عدد گروه است. استثناء فلوئور و اکسیژن است، زیرا بالاترین حالت اکسیداسیون آنها کمتر از تعداد گروهی است که در آن یافت می شود. عناصر زیر گروه مس ترکیباتی را تشکیل می دهند که در آن حالت اکسیداسیون آنها از تعداد گروه بیشتر است (CuO, AgF 5, AuCl 3).
حداکثر حالت اکسیداسیون منفی عناصر واقع در زیر گروه های اصلی جدول تناوبی را می توان با کم کردن عدد گروه از هشت تعیین کرد. برای کربن 8 - 4 = 4، برای فسفر - 8 - 5 = 3 است.
در زیرگروههای اصلی، هنگام حرکت از عناصر از بالا به پایین، پایداری بالاترین حالت اکسیداسیون مثبت کاهش مییابد؛ برعکس، در زیرگروههای ثانویه، از بالا به پایین، پایداری حالتهای اکسیداسیون بالاتر افزایش مییابد.
مرسوم بودن مفهوم حالت اکسیداسیون را می توان با استفاده از مثال برخی از ترکیبات معدنی و آلی نشان داد. به طور خاص، در اسیدهای فسفینیک (فسفر) H 3 PO 2، فسفونیک (فسفر) H 3 PO 3 و فسفریک H 3 PO 4، حالت های اکسیداسیون فسفر به ترتیب +1، +3 و +5 است، در حالی که در همه این ترکیبات فسفر پنج ظرفیتی است. برای کربن موجود در متان CH 4، متانول CH 3 OH، فرمالدئید CH 2 O، اسید فرمیک HCOOH و مونوکسید کربن (IV) CO 2، حالت های اکسیداسیون کربن به ترتیب -4، -2، 0، +2 و +4 است. ، در حالی که ظرفیت اتم کربن در همه این ترکیبات چهار است.
با وجود این واقعیت که حالت اکسیداسیون یک مفهوم متعارف است، به طور گسترده ای در ترکیب واکنش های ردوکس استفاده می شود.
7.2.2. مهمترین عوامل اکسید کننده و کاهنده
عوامل اکسید کننده معمولی عبارتند از:
1. مواد ساده ای که اتم های آنها الکترونگاتیوی بالایی دارند. اینها اول از همه عناصر زیرگروه های اصلی VI و VII از گروه های جدول تناوبی هستند: اکسیژن، هالوژن. از میان مواد ساده، قوی ترین عامل اکسید کننده فلوئور است.
2. ترکیبات حاوی برخی کاتیون های فلزی در حالت های اکسیداسیون بالا: Pb 4+، Fe 3+، Au 3+ و غیره.
3. ترکیبات حاوی چند آنیون پیچیده، عناصری که در آنها حالت اکسیداسیون مثبت بالایی دارند: 2–، – و غیره.
عوامل کاهش دهنده عبارتند از:
1. مواد ساده ای که اتم های آنها الکترونگاتیوی کمی دارند، فلزات فعال هستند. غیر فلزات مانند هیدروژن و کربن نیز می توانند خواص کاهشی از خود نشان دهند.
2. برخی از ترکیبات فلزی حاوی کاتیون (Sn 2+, Fe 2+, Cr 2+) که با اهدای الکترون می توانند حالت اکسیداسیون خود را افزایش دهند.
3. برخی از ترکیبات حاوی یون های ساده مانند I – , S 2– .
4. ترکیبات حاوی یون های پیچیده (S 4+ O 3) 2–, (НР 3+ O 3) 2– که در آنها عناصر می توانند با اهدای الکترون، حالت اکسیداسیون مثبت خود را افزایش دهند.
در عمل آزمایشگاهی، بیشتر از عوامل اکسید کننده زیر استفاده می شود:
پرمنگنات پتاسیم (KMnO 4)؛
دی کرومات پتاسیم (K2Cr2O7)؛
اسید نیتریک (HNO 3)؛
اسید سولفوریک غلیظ (H2SO4)؛
پراکسید هیدروژن (H2O2)؛
اکسیدهای منگنز (IV) و سرب (IV) (MnO2، PbO2).
نیترات پتاسیم مذاب (KNO 3) و ذوب برخی نیترات های دیگر.
عوامل کاهنده مورد استفاده در عمل آزمایشگاهی عبارتند از:
- منیزیم (Mg)، آلومینیوم (Al) و سایر فلزات فعال؛
- هیدروژن (H2) و کربن (C)؛
- یدید پتاسیم (KI)؛
- سولفید سدیم (Na2S) و سولفید هیدروژن (H2S)؛
- سولفیت سدیم (Na 2 SO 3 )؛
- کلرید قلع (SnCl 2).
7.2.3. طبقه بندی واکنش های ردوکس
واکنشهای ردوکس معمولاً به سه نوع تقسیم میشوند: واکنشهای بین مولکولی، درون مولکولی و واکنشهای نامتناسب (خوداکسیداسیون-خودکاهشی).
واکنش های بین مولکولیبا تغییر در حالت اکسیداسیون اتم هایی که در مولکول های مختلف یافت می شوند رخ می دهد. مثلا:
2 Al + Fe 2 O 3 Al 2 O 3 + 2 Fe,
C + 4 HNO 3 (conc) = CO 2 + 4 NO 2 + 2 H 2 O.
به واکنش های درون مولکولیاینها واکنش هایی هستند که در آنها عامل اکسید کننده و عامل کاهنده بخشی از یک مولکول هستند، به عنوان مثال:
(NH 4) 2 Cr 2 O 7 N 2 + Cr 2 O 3 + 4 H 2 O،
2 KNO 3 2 KNO 2 + O 2 .
که در واکنش های عدم تناسب(خود اکسیداسیون - خودکاهشی) یک اتم (یون) از همان عنصر هم یک عامل اکسید کننده و هم یک عامل کاهنده است:
Cl 2 + 2 KOH KCl + KClO + H 2 O،
2 NO 2 + 2 NaOH = NaNO 2 + NaNO 3 + H 2 O.
7.2.4. قوانین اساسی برای ترکیب واکنش های ردوکس
ترکیب واکنش های ردوکس طبق مراحل ارائه شده در جدول انجام می شود. 7.2.
جدول 7.2
مراحل تدوین معادلات برای واکنش های ردوکس
عمل |
|
عامل اکسید کننده و عامل کاهنده را تعیین کنید. |
|
محصولات واکنش ردوکس را شناسایی کنید. |
|
تعادل الکترونی ایجاد کنید و از آن برای تعیین ضرایب برای موادی که حالت اکسیداسیون آنها را تغییر می دهند استفاده کنید. |
|
ضرایب را برای سایر موادی که در واکنش ردوکس شرکت می کنند و تشکیل می شوند ترتیب دهید. |
|
صحت ضرایب را با شمارش مقدار ماده اتم ها (معمولاً هیدروژن و اکسیژن) که در سمت چپ و راست معادله واکنش قرار دارند، بررسی کنید. |
بیایید قوانین ترکیب واکنش های ردوکس را با استفاده از مثال تعامل سولفیت پتاسیم با پرمنگنات پتاسیم در یک محیط اسیدی در نظر بگیریم:
1. تعیین عامل اکسید کننده و عامل کاهنده
منگنز که در بالاترین حالت اکسیداسیون قرار دارد نمی تواند الکترون ها را رها کند. Mn 7+ الکترون ها را می پذیرد، یعنی. یک عامل اکسید کننده است.
یون S 4+ می تواند دو الکترون بدهد و به S 6+ برود، یعنی. یک عامل کاهنده است بنابراین، در واکنش مورد بررسی، K2SO3 یک عامل کاهنده و KMnO4 یک عامل اکسید کننده است.
2. ایجاد محصولات واکنش
K2SO3 + KMnO4 + H2SO4؟
با اهدای دو الکترون به یک الکترون، S 4+ تبدیل به S 6+ می شود. بنابراین سولفیت پتاسیم (K 2 SO 3 ) به سولفات ( K 2 SO 4 ) تبدیل می شود. در محیط اسیدی، Mn 7+ 5 الکترون می پذیرد و در محلول اسید سولفوریک (متوسط) سولفات منگنز (MnSO 4) تشکیل می دهد. در نتیجه این واکنش، مولکول های اضافی سولفات پتاسیم نیز (به دلیل یون های پتاسیم موجود در پرمنگنات) و همچنین مولکول های آب تشکیل می شود. بنابراین، واکنش مورد بررسی به صورت زیر نوشته می شود:
K 2 SO 3 + KMnO 4 + H 2 SO 4 = K 2 SO 4 + MnSO 4 + H 2 O .
3. جمع آوری تعادل الکترون
برای جمعآوری تعادل الکترونی، لازم است آن حالتهای اکسیداسیونی که در واکنش مورد بررسی تغییر میکنند نشان دهیم:
K 2 S 4 + O 3 + KMn 7 + O 4 + H 2 SO 4 = K 2 S 6 + O 4 + Mn 2 + SO 4 + H 2 O.
Mn 7+ + 5 e = Mn 2+ ;
S 4+ – 2 e = S 6+.
تعداد الکترون هایی که عامل احیا کننده می دهد باید برابر با تعداد الکترون های پذیرفته شده توسط عامل اکسید کننده باشد. بنابراین، دو Mn 7 + و پنج S 4 + باید در واکنش شرکت کنند:
Mn 7+ + 5 e = Mn 2+ 2،
S 4+ – 2 e = S 6+ 5.
بنابراین، تعداد الکترون هایی که عامل احیا کننده (10) می دهد، برابر با تعداد الکترون های پذیرفته شده توسط عامل اکسید کننده (10) خواهد بود.
4. ترتیب ضرایب در معادله واکنش
مطابق با تعادل الکترون ها، لازم است ضریب 5 را در مقابل K 2 SO 3 و 2 را در مقابل KMnO 4 قرار دهیم. در سمت راست، در مقابل سولفات پتاسیم، ضریب 6 را تعیین می کنیم. از آنجایی که یک مولکول به پنج مولکول K 2 SO 4 که در طی اکسیداسیون سولفیت پتاسیم K 2 SO 4 در نتیجه اتصال یون های پتاسیم موجود در پرمنگنات تشکیل شده اند اضافه می شود. از آنجایی که واکنش شامل دومولکول های پرمنگنات، در سمت راست نیز تشکیل می شود دومولکول های سولفات منگنز برای اتصال محصولات واکنش (یون های پتاسیم و منگنز موجود در پرمنگنات) لازم است. سهبنابراین، مولکول های اسید سولفوریک در نتیجه واکنش، سهمولکول های آب در نهایت می رسیم:
5 K 2 SO 3 + 2 KMnO 4 + 3 H 2 SO 4 = 6 K 2 SO 4 + 2 MnSO 4 + 3 H 2 O .
5. بررسی صحت ضرایب در معادله واکنش
تعداد اتم های اکسیژن در سمت چپ معادله واکنش برابر است با:
5 3 + 2 4 + 3 4 = 35.
در سمت راست این عدد خواهد بود:
6 4 + 2 4 + 3 1 = 35.
تعداد اتم های هیدروژن در سمت چپ معادله واکنش شش است و مطابق با تعداد این اتم ها در سمت راست معادله واکنش است.
7.2.5. نمونه هایی از واکنش های ردوکس شامل عوامل اکسید کننده و کاهنده معمولی
7.2.5.1. واکنش های بین مولکولی اکسیداسیون کاهش
در زیر، به عنوان نمونه، واکنشهای ردوکس شامل پرمنگنات پتاسیم، دی کرومات پتاسیم، پراکسید هیدروژن، نیتریت پتاسیم، یدید پتاسیم و سولفید پتاسیم را در نظر میگیریم. واکنش های ردوکس شامل سایر عوامل اکسید کننده و کاهنده معمولی در قسمت دوم کتابچه راهنمای ("شیمی معدنی") مورد بحث قرار گرفته است.
واکنش های ردوکس شامل پرمنگنات پتاسیم
بسته به محیط (اسیدی، خنثی، قلیایی)، پرمنگنات پتاسیم، که به عنوان یک عامل اکسید کننده عمل می کند، محصولات احیای مختلفی می دهد. 7.1.

برنج. 7.1. تشکیل محصولات احیای پرمنگنات پتاسیم در محیط های مختلف
در زیر واکنش های KMnO 4 با سولفید پتاسیم به عنوان یک عامل کاهنده در محیط های مختلف آورده شده است که این طرح را نشان می دهد، شکل. 7.1. در این واکنش ها محصول اکسیداسیون یون سولفید گوگرد آزاد است. در یک محیط قلیایی، مولکول های KOH در واکنش شرکت نمی کنند، بلکه فقط محصول کاهش پرمنگنات پتاسیم را تعیین می کنند.
5 K 2 S + 2 KMnO 4 + 8 H 2 SO 4 = 5 S + 2 MnSO 4 + 6 K 2 SO 4 + 8 H 2 O ،
3 K 2 S + 2 KMnO 4 + 4 H 2 O 2 MnO 2 + 3 S + 8 KOH،
K 2 S + 2 KMnO 4 – (KOH) 2 K 2 MnO 4 + S.
واکنش های ردوکس شامل دی کرومات پتاسیم
در یک محیط اسیدی، دی کرومات پتاسیم یک عامل اکسید کننده قوی است. مخلوطی از K 2 Cr 2 O 7 و H 2 SO 4 غلیظ (کروم) به طور گسترده در عمل آزمایشگاهی به عنوان یک عامل اکسید کننده استفاده می شود. در تعامل با یک عامل کاهنده، یک مولکول دی کرومات پتاسیم شش الکترون را می پذیرد و ترکیبات کروم سه ظرفیتی را تشکیل می دهد:
6 FeSO 4 + K 2 Cr 2 O 7 + 7 H 2 SO 4 = 3 Fe 2 (SO 4) 3 + Cr 2 (SO 4) 3 + K 2 SO 4 + 7 H 2 O ;
6 KI + K 2 Cr 2 O 7 + 7 H 2 SO 4 = 3 I 2 + Cr 2 (SO 4) 3 + 4 K 2 SO 4 + 7 H 2 O.
واکنش های ردوکس شامل پراکسید هیدروژن و نیتریت پتاسیم
پراکسید هیدروژن و نیتریت پتاسیم عمدتاً دارای خواص اکسید کننده هستند:
H 2 S + H 2 O 2 = S + 2 H 2 O،
2 KI + 2 KNO 2 + 2 H 2 SO 4 = I 2 + 2 K 2 SO 4 + H 2 O،
با این حال، هنگام تعامل با عوامل اکسید کننده قوی (مانند، برای مثال، KMnO 4)، پراکسید هیدروژن و نیتریت پتاسیم به عنوان عوامل کاهنده عمل می کنند:
5 H 2 O 2 + 2 KMnO 4 + 3 H 2 SO 4 = 5 O 2 + 2 MnSO 4 + K 2 SO 4 + 8 H 2 O،
5 KNO 2 + 2 KMnO 4 + 3 H 2 SO 4 = 5 KNO 3 + 2 MnSO 4 + K 2 SO 4 + 3 H 2 O.
لازم به ذکر است که پراکسید هیدروژن، بسته به محیط، طبق طرح، کاهش می یابد. 7.2.

برنج. 7.2. محصولات احتمالی کاهش پراکسید هیدروژن
در این حالت، در نتیجه واکنش ها، یون های آب یا هیدروکسید تشکیل می شوند:
2 FeSO 4 + H 2 O 2 + H 2 SO 4 = Fe 2 (SO 4) 3 + 2 H 2 O ،
2 KI + H 2 O 2 = I 2 + 2 KOH.
7.2.5.2. واکنش های درون مولکولی اکسیداسیون کاهش
واکنشهای ردوکس درون مولکولی معمولاً زمانی اتفاق میافتد که موادی که مولکولهای آنها حاوی یک عامل کاهنده و یک عامل اکسید کننده هستند، گرم شوند. نمونه هایی از واکنش های احیا-اکسیداسیون درون مولکولی فرآیندهای تجزیه حرارتی نیترات ها و پرمنگنات پتاسیم هستند:
2 NaNO 3 2 NaNO 2 + O 2،
2 مس (NO 3) 2 2 CuO + 4 NO 2 + O 2،
جیوه (NO 3) 2 جیوه + NO 2 + O 2،
2 KMnO 4 K 2 MnO 4 + MnO 2 + O 2.
7.2.5.3. واکنش های عدم تناسب
همانطور که در بالا ذکر شد، در واکنش های عدم تناسب همان اتم (یون) هم یک عامل اکسید کننده و هم یک عامل کاهنده است. اجازه دهید روند تشکیل این نوع واکنش را با استفاده از مثال برهمکنش گوگرد با قلیایی در نظر بگیریم.
حالت های اکسیداسیون مشخصه گوگرد: – 2، 0، +4 و +6. گوگرد عنصری به عنوان یک عامل کاهنده 4 الکترون اهدا می کند:
بنابراین – 4e = S 4+.
گوگرد – عامل اکسید کننده دو الکترون را می پذیرد:
S o + 2е = S 2– .
بنابراین در نتیجه واکنش عدم تناسب گوگرد، ترکیباتی تشکیل می شود که حالت اکسیداسیون عنصر آنها – 2 و راست +4:
3 S + 6 KOH = 2 K 2 S + K 2 SO 3 + 3 H 2 O.
هنگامی که اکسید نیتروژن (IV) در قلیایی نامتناسب باشد، نیتریت و نیترات به دست می آیند - ترکیباتی که در آنها حالت اکسیداسیون نیتروژن به ترتیب +3 و +5 است:
2 N 4 + O 2 + 2 KOH = KN 3 + O 2 + KN 5 + O 3 + H 2 O،
عدم تناسب کلر در محلول قلیایی سرد منجر به تشکیل هیپوکلریت و در محلول قلیایی داغ - کلرات می شود:
Cl 0 2 + 2 KOH = KCl – + KCl + O + H 2 O،
Cl 0 2 + 6 KOH 5 KCl – + KCl 5 + O 3 + 3H 2 O.
7.3. الکترولیز
فرآیند ردوکس که در محلول ها اتفاق می افتد یا با عبور جریان الکتریکی مستقیم از آنها ذوب می شود، الکترولیز نامیده می شود. در این حالت، اکسیداسیون آنیون ها در الکترود مثبت (آند) اتفاق می افتد. کاتیون ها در الکترود منفی (کاتد) کاهش می یابند.
2 Na 2 CO 3 4 Na + O 2 + 2CO 2 .
در طول الکترولیز محلول های آبی الکترولیت ها، همراه با تبدیل ماده محلول، فرآیندهای الکتروشیمیایی می توانند با مشارکت یون های هیدروژن و یون های هیدروکسید آب رخ دهند:
کاتد (–): 2 Н + + 2е = Н 2،
آند (+): 4 OH – – 4e = O 2 + 2 H 2 O.
در این حالت، فرآیند کاهش در کاتد به صورت زیر انجام می شود:
1. کاتیون های فلزات فعال (تا Al 3+ شامل) در کاتد احیا نمی شوند، در عوض هیدروژن احیا می شود.
2. کاتیون های فلزی واقع در سری پتانسیل های الکترود استاندارد (در سری ولتاژ) در سمت راست هیدروژن در طی الکترولیز به فلزات آزاد در کاتد تبدیل می شوند.
3. کاتیون های فلزی واقع بین Al 3+ و H + همزمان با کاتیون هیدروژن در کاتد احیا می شوند.
فرآیندهایی که در محلول های آبی در آند رخ می دهند به ماده ای که آند از آن ساخته شده است بستگی دارد. آندهای نامحلول وجود دارد ( بی اثر) و محلول ( فعال). گرافیت یا پلاتین به عنوان ماده آندهای بی اثر استفاده می شود. آندهای محلول از مس، روی و سایر فلزات ساخته می شوند.
در طول الکترولیز محلول ها با یک آند بی اثر، محصولات زیر را می توان تشکیل داد:
1. هنگامی که یون های هالید اکسید می شوند، هالوژن های آزاد آزاد می شوند.
2. در طول الکترولیز محلول های حاوی آنیون های SO 2 2-، NO 3 -، PO 4 3-، اکسیژن آزاد می شود، یعنی. این یون ها نیستند که در آند اکسید می شوند، بلکه مولکول های آب هستند.
با در نظر گرفتن قوانین فوق، اجازه دهید به عنوان مثال، الکترولیز محلول های آبی NaCl، CuSO4 و KOH با الکترودهای بی اثر را در نظر بگیریم.
1). در محلول، کلرید سدیم به یون تجزیه می شود.
بین معادله واکنش و ویژگی عنصر نیتروژنی که در این واکنش نشان می دهد مطابقت برقرار کنید: برای هر موقعیتی که با یک حرف مشخص می شود، موقعیت مربوطه را که با یک عدد نشان داده شده است انتخاب کنید.
اعداد انتخاب شده را در جدول زیر حروف مربوطه بنویسید.
جواب: 4221
توضیح:
الف) NH 4 HCO 3 نمکی است که حاوی کاتیون آمونیوم NH 4 + است. در کاتیون آمونیوم نیتروژن همیشه حالت اکسیداسیون 3- دارد. در نتیجه واکنش به آمونیاک NH 3 تبدیل می شود. هیدروژن تقریباً همیشه (به جز ترکیبات آن با فلزات) حالت اکسیداسیون +1 دارد. بنابراین، برای اینکه یک مولکول آمونیاک از نظر الکتریکی خنثی باشد، نیتروژن باید حالت اکسیداسیون 3- داشته باشد. بنابراین، هیچ تغییری در درجه اکسیداسیون نیتروژن وجود ندارد، یعنی. خواص ردوکس را نشان نمی دهد.
ب) همانطور که در بالا نشان داده شد، نیتروژن موجود در آمونیاک NH 3 دارای حالت اکسیداسیون 3- است. در نتیجه واکنش با CuO، آمونیاک به یک ماده ساده N 2 تبدیل می شود. در هر ماده ساده، حالت اکسیداسیون عنصری که توسط آن تشکیل شده است صفر است. بنابراین، اتم نیتروژن بار منفی خود را از دست می دهد و از آنجایی که الکترون ها مسئول بار منفی هستند، به این معنی است که اتم نیتروژن آنها را در نتیجه واکنش از دست می دهد. عنصری که در اثر واکنش مقداری از الکترون های خود را از دست می دهد، عامل احیا کننده نامیده می شود.
ج) در نتیجه واکنش NH 3 با حالت اکسیداسیون نیتروژن برابر 3- به اکسید نیتریک NO تبدیل می شود. اکسیژن تقریباً همیشه حالت اکسیداسیون 2- دارد. بنابراین، برای اینکه یک مولکول اکسید نیتریک از نظر الکتریکی خنثی باشد، اتم نیتروژن باید حالت اکسیداسیون 2+ داشته باشد. این بدان معنی است که اتم نیتروژن در نتیجه واکنش حالت اکسیداسیون خود را از -3 به +2 تغییر داد. این نشان می دهد که اتم نیتروژن 5 الکترون از دست داده است. یعنی نیتروژن، همانطور که در مورد B وجود دارد، یک عامل کاهنده است.
د) N 2 یک ماده ساده است. در تمام مواد ساده، عنصری که آنها را تشکیل می دهد، حالت اکسیداسیون 0 دارد. در نتیجه واکنش، نیتروژن به لیتیوم نیترید Li3N تبدیل می شود. تنها حالت اکسیداسیون یک فلز قلیایی غیر از صفر (حالت اکسیداسیون 0 برای هر عنصری رخ می دهد) 1+ است. بنابراین، برای اینکه واحد ساختاری Li3N از نظر الکتریکی خنثی باشد، نیتروژن باید حالت اکسیداسیون 3- داشته باشد. معلوم شد که در نتیجه واکنش، نیتروژن بار منفی به دست آورد که به معنای افزودن الکترون است. نیتروژن یک عامل اکسید کننده در این واکنش است.
تعریف
حالت اکسیداسیونارزیابی کمی از وضعیت یک اتم یک عنصر شیمیایی در یک ترکیب، بر اساس الکترونگاتیوی آن است.
هر دو ارزش مثبت و منفی را می گیرد. برای نشان دادن حالت اکسیداسیون یک عنصر در یک ترکیب، باید یک عدد عربی با علامت مربوطه ("+" یا "-") در بالای نماد آن قرار دهید.
باید به خاطر داشت که حالت اکسیداسیون کمیتی است که معنای فیزیکی ندارد، زیرا بار واقعی اتم را منعکس نمی کند. با این حال، این مفهوم بسیار گسترده در شیمی استفاده می شود.
جدول حالت های اکسیداسیون عناصر شیمیایی
حداکثر حالت اکسیداسیون مثبت و حداقل منفی را می توان با استفاده از جدول تناوبی D.I تعیین کرد. مندلیف. آنها به ترتیب با تعداد گروهی که عنصر در آن قرار دارد و تفاوت بین مقدار "بالاترین" حالت اکسیداسیون و عدد 8 برابر است.
اگر ترکیبات شیمیایی را به طور خاص در نظر بگیریم، در مواد با پیوندهای غیر قطبی، حالت اکسیداسیون عناصر صفر است (N 2، H 2، Cl 2).
حالت اکسیداسیون فلزات در حالت عنصری صفر است، زیرا توزیع چگالی الکترون در آنها یکنواخت است.
در ترکیبات یونی ساده، حالت اکسیداسیون عناصر موجود در آنها برابر با بار الکتریکی است، زیرا در طول تشکیل این ترکیبات، انتقال تقریباً کامل الکترون ها از یک اتم به اتم دیگر وجود دارد: Na +1 I -1، Mg. +2 Cl -1 2، Al +3 F - 1 3، Zr +4 Br -1 4.
هنگام تعیین وضعیت اکسیداسیون عناصر در ترکیبات با پیوندهای کووالانسی قطبی، مقادیر الکترونگاتیوی آنها مقایسه می شود. از آنجا که در طول تشکیل یک پیوند شیمیایی، الکترون ها به اتم های عناصر الکترونگاتیو بیشتری جابه جا می شوند، دومی در ترکیبات حالت اکسیداسیون منفی دارند.
عناصری وجود دارند که تنها با یک مقدار حالت اکسیداسیون مشخص می شوند (فلورین، فلزات گروه های IA و IIA و غیره). فلوئور که با بالاترین مقدار الکترونگاتیوی مشخص می شود، همیشه یک حالت اکسیداسیون منفی ثابت (-1) در ترکیبات دارد.
عناصر قلیایی و قلیایی خاکی که با مقدار الکترونگاتیوی نسبتاً پایین مشخص می شوند، همیشه حالت اکسیداسیون مثبت به ترتیب برابر با (1+) و (+2) دارند.
با این حال، عناصر شیمیایی نیز وجود دارند که با چندین حالت اکسیداسیون مشخص می شوند (گوگرد - (-2)، 0، (+2)، (+4)، (+6، و غیره).
برای سهولت در به خاطر سپردن تعداد و چه حالت های اکسیداسیون مشخصه یک عنصر شیمیایی خاص، از جداول حالت های اکسیداسیون عناصر شیمیایی استفاده کنید که به شکل زیر است:
|
شماره سریال |
روسی / انگلیسی نام |
نماد شیمیایی |
حالت اکسیداسیون |
|
هیدروژن |
|||
|
هلیوم |
|||
|
لیتیوم |
|||
|
بریلیم |
|||
|
(-1), 0, (+1), (+2), (+3) |
|||
|
کربن |
(-4), (-3), (-2), (-1), 0, (+2), (+4) |
||
|
نیتروژن / نیتروژن |
(-3), (-2), (-1), 0, (+1), (+2), (+3), (+4), (+5) |
||
|
اکسیژن |
(-2), (-1), 0, (+1), (+2) |
||
|
فلوئور |
|||
|
سدیم/سدیم |
|||
|
منیزیم / منیزیم |
|||
|
آلومینیوم |
|||
|
سیلیکون |
(-4), 0, (+2), (+4) |
||
|
فسفر / فسفر |
(-3), 0, (+3), (+5) |
||
|
گوگرد/گوگرد |
(-2), 0, (+4), (+6) |
||
|
کلر |
(-1)، 0، (+1)، (+3)، (+5)، (+7)، به ندرت (+2) و (+4) |
||
|
آرگون / آرگون |
|||
|
پتاسیم/پتاسیم |
|||
|
کلسیم |
|||
|
اسکاندیم / اسکاندیم |
|||
|
تیتانیوم |
(+2), (+3), (+4) |
||
|
وانادیوم |
(+2), (+3), (+4), (+5) |
||
|
کروم / کرومیوم |
(+2), (+3), (+6) |
||
|
منگنز / منگنز |
(+2), (+3), (+4), (+6), (+7) |
||
|
اهن |
(+2)، (+3)، نادر (+4) و (+6) |
||
|
کبالت |
(+2)، (+3)، به ندرت (+4) |
||
|
نیکل |
(+2)، نادر (+1)، (+3) و (+4) |
||
|
فلز مس |
+1، +2، نادر (+3) |
||
|
گالیوم |
(+3)، نادر (+2) |
||
|
ژرمانیوم / ژرمانیوم |
(-4), (+2), (+4) |
||
|
آرسنیک/آرسنیک |
(-3)، (+3)، (+5)، به ندرت (+2) |
||
|
سلنیوم |
(-2)، (+4)، (+6)، به ندرت (+2) |
||
|
برم |
(-1)، (+1)، (+5)، به ندرت (+3)، (+4) |
||
|
کریپتون / کریپتون |
|||
|
روبیدیوم / روبیدیوم |
|||
|
استرانسیوم / استرانسیوم |
|||
|
ایتریوم / ایتریوم |
|||
|
زیرکونیوم / زیرکونیوم |
(+4)، نادر (+2) و (+3) |
||
|
نیوبیوم / نیوبیوم |
(+3)، (+5)، نادر (+2) و (+4) |
||
|
مولیبدن |
(+3)، (+6)، نادر (+2)، (+3) و (+5) |
||
|
تکنتیوم / تکنتیوم |
|||
|
روتنیوم / روتنیوم |
(+3)، (+4)، (+8)، نادر (+2)، (+6) و (+7) |
||
|
رودیوم |
(+4)، نادر (+2)، (+3) و (+6) |
||
|
پالادیوم |
(+2)، (+4)، به ندرت (+6) |
||
|
نقره |
(+1)، نادر (+2) و (+3) |
||
|
کادمیوم |
(+2)، نادر (+1) |
||
|
ایندیوم |
(+3)، نادر (+1) و (+2) |
||
|
تن تن |
(+2), (+4) |
||
|
آنتیموان / آنتیموان |
(-3)، (+3)، (+5)، به ندرت (+4) |
||
|
تلوریوم / تلوریوم |
(-2)، (+4)، (+6)، به ندرت (+2) |
||
|
(-1)، (+1)، (+5)، (+7)، به ندرت (+3)، (+4) |
|||
|
زنون / زنون |
|||
|
سزیم |
|||
|
باریم / باریم |
|||
|
لانتانیم / لانتانیم |
|||
|
سریم |
(+3), (+4) |
||
|
پراسئودیمیوم / Praseodymium |
|||
|
نئودیمیم / نئودیمیم |
(+3), (+4) |
||
|
پرومتیم / پرومتیم |
|||
|
ساماریوم / ساماریوم |
(+3)، نادر (+2) |
||
|
یوروپیوم |
(+3)، نادر (+2) |
||
|
گادولینیوم / Gadolinium |
|||
|
تربیوم / تربیوم |
(+3), (+4) |
||
|
دیسپروزیم / Dysprosium |
|||
|
هولمیوم |
|||
|
اربیوم |
|||
|
تولیوم |
(+3)، نادر (+2) |
||
|
ایتربیوم / ایتربیوم |
(+3)، نادر (+2) |
||
|
لوتتیوم / لوتتیوم |
|||
|
هافنیوم / هافنیوم |
|||
|
تانتالوم / تانتالیم |
(+5)، نادر (+3)، (+4) |
||
|
تنگستن / تنگستن |
(+6)، نادر (+2)، (+3)، (+4) و (+5) |
||
|
رنیوم / رنیوم |
(+2)، (+4)، (+6)، (+7)، نادر (-1)، (+1)، (+3)، (+5) |
||
|
اوسمیوم / اوسمیوم |
(+3)، (+4)، (+6)، (+8)، نادر (+2) |
||
|
ایریدیوم / ایریدیوم |
(+3)، (+4)، (+6)، به ندرت (+1) و (+2) |
||
|
پلاتین |
(+2)، (+4)، (+6)، نادر (+1) و (+3) |
||
|
طلا |
(+1)، (+3)، به ندرت (+2) |
||
|
سیاره تیر |
(+1), (+2) |
||
|
تالیم / تالیم |
(+1)، (+3)، به ندرت (+2) |
||
|
سرب / سرب |
(+2), (+4) |
||
|
بیسموت |
(+3)، نادر (+3)، (+2)، (+4) و (+5) |
||
|
پولونیوم |
(+2)، (+4)، به ندرت (2-) و (+6) |
||
|
استاتین |
|||
|
رادون / رادون |
|||
|
فرانسیوم |
|||
|
رادیوم |
|||
|
اکتینیوم |
|||
|
توریم |
|||
|
پرواکتینیم / پروتاکتینیم |
|||
|
اورانیوم / اورانیوم |
(+3)، (+4)، (+6)، نادر (+2) و (+5) |
نمونه هایی از حل مسئله
مثال 1
- حالت اکسیداسیون فسفر در فسفین (3-) و در اسید اورتوفسفریک - (5+) است. تغییر در حالت اکسیداسیون فسفر: +3 → +5، یعنی. گزینه اول پاسخ
- حالت اکسیداسیون یک عنصر شیمیایی در یک ماده ساده صفر است. درجه اکسیداسیون فسفر در اکسید ترکیب P 2 O 5 (+5) است. تغییر در حالت اکسیداسیون فسفر: 0 → +5، یعنی. گزینه سوم پاسخ
- درجه اکسیداسیون فسفر در ترکیب اسیدی HPO 3 (5+) و H3PO2 (1+) است. تغییر در حالت اکسیداسیون فسفر: +5 → +1، یعنی. گزینه پاسخ پنجم
مثال 2
| ورزش | حالت اکسیداسیون (-3) کربن در ترکیب عبارت است از: الف) CH 3 Cl. ب) C 2 H 2; ج) HCOH; د) C 2 H 6. |
| راه حل | به منظور پاسخ صحیح به سوال مطرح شده، به طور متناوب درجه اکسیداسیون کربن را در هر یک از ترکیبات پیشنهادی تعیین می کنیم. الف) حالت اکسیداسیون هیدروژن (1+) و کلر (1-) است. اجازه دهید حالت اکسیداسیون کربن را به صورت x در نظر بگیریم: x + 3×1 + (-1) =0; پاسخ نادرست است. ب) حالت اکسیداسیون هیدروژن (+1) است. اجازه دهید حالت اکسیداسیون کربن را به صورت "y" در نظر بگیریم: 2×y + 2×1 = 0; پاسخ نادرست است. ج) حالت اکسیداسیون هیدروژن (1+) و اکسیژن (2-) است. اجازه دهید حالت اکسیداسیون کربن را به صورت z در نظر بگیریم: 1 + z + (-2) +1 = 0: پاسخ نادرست است. د) حالت اکسیداسیون هیدروژن (+1) است. اجازه دهید حالت اکسیداسیون کربن را به صورت "a" در نظر بگیریم: 2×a + 6×1 = 0; پاسخ صحیح. |
| پاسخ | گزینه (د) |
واکنش شیمیایی فرآیندی است که در آن مواد اولیه به محصولات واکنش تبدیل می شوند. موادی که پس از اتمام واکنش به دست می آیند فرآورده نامیده می شوند. آنها ممکن است از نظر ساختار، ترکیب یا هر دو با نمونه های اصلی متفاوت باشند.
بر اساس تغییرات در ترکیب، انواع واکنش های شیمیایی زیر متمایز می شوند:
- با تغییر در ترکیب (بیشتر آنها)؛
- بدون تغییر ترکیب (ایزومریزاسیون و تبدیل یک اصلاح آلوتروپیک به دیگری).
اگر ترکیب یک ماده در نتیجه واکنش تغییر نکند، ساختار آن لزوما تغییر می کند، به عنوان مثال: Cgraphite↔Salmaz.
اجازه دهید طبقه بندی واکنش های شیمیایی را که با تغییر در ترکیب رخ می دهد با جزئیات بیشتری در نظر بگیریم.
ط - با توجه به تعداد و ترکیب مواد
واکنش های مرکب
در نتیجه چنین فرآیندهای شیمیایی، یک ماده از چندین ماده تشکیل می شود: A + B + ... = C
قابلیت اتصال:
- مواد ساده: 2Na + S = Na2S.
- ساده با پیچیده: 2SO2 + O2 = 2SO3;
- دو پیچیده: CaO + H2O = Ca(OH)2.
- بیش از دو ماده: 4Fe + 3O2 + 6H2O = 4Fe(OH)3
واکنش های تجزیه
یک ماده در چنین واکنش هایی به چندین ماده دیگر تجزیه می شود: A=B+C+...
محصولات در این مورد می توانند:
- مواد ساده: 2NaCl = 2Na + Cl2
- ساده و پیچیده: 2KNO3 = 2KNO2 + O2
- دو پیچیده: CaCO3 = CaO + CO2
- بیش از دو محصول: 2AgNO3 = 2Ag + O2 + 2NO2
واکنش های جایگزینی
چنین واکنش هایی که در آن مواد ساده و پیچیده با یکدیگر واکنش می دهند و اتم های یک ماده ساده جایگزین اتم های یکی از عناصر در یک عنصر پیچیده می شوند، واکنش های جانشینی نامیده می شوند. به طور شماتیک، فرآیند جایگزینی اتم ها را می توان به صورت زیر نشان داد: A + BC = B + AC.
برای مثال CuSO4 + Fe = FeSO4 + Cu
واکنش های مبادله ای
این گروه شامل واکنش هایی است که طی آن دو ماده پیچیده اجزای خود را مبادله می کنند: AB + CD = AD + CB. طبق قانون برتوله، وقوع غیرقابل برگشت چنین واکنش هایی در صورتی امکان پذیر است که حداقل یکی از محصولات:
- رسوب (ماده نامحلول): 2NaOH + CuSO4 = Cu(OH)2 + Na2SO4;
- ماده تجزیه کم: NaOH + HCl = NaCl + H2O.
- گاز: NaOH + NH4Cl = NaCl + NH3 + H2O (ابتدا هیدرات آمونیاک NH3 H2O تشکیل می شود که پس از دریافت بلافاصله به آمونیاک و آب تجزیه می شود).
II. با اثر حرارتی
- گرمازا
- فرآیندهایی که با انتشار گرما رخ می دهد:
C + O2 = CO2 + Q - گرماگیر
- واکنش هایی که در آن گرما جذب می شود:
Cu(OH)2 = CuO + H2O – Q
III. انواع واکنش های شیمیایی بر اساس جهت
- برگشت پذیرواکنش هایی هستند که همزمان در هر دو جهت رو به جلو و معکوس رخ می دهند: N2 + O2 ↔ 2NO
- برگشت ناپذیر فرآیندها به پایان می رسند، یعنی تا زمانی که حداقل یکی از مواد واکنش دهنده به طور کامل مصرف شود. نمونه هایی از واکنش های مبادله برگشت ناپذیر در بالا مورد بحث قرار گرفت.
IV. با توجه به وجود کاتالیزور

V- با توجه به حالت تجمع مواد
- اگر همه واکنش دهنده ها در یک حالت تجمع باشند، واکنش نامیده می شود همگن. چنین فرآیندهایی در کل حجم اتفاق می افتد. به عنوان مثال: NaOH + HCl = NaCl + H2O
- ناهمگون واکنشهایی بین مواد در حالتهای مختلف تجمع هستند که در سطح مشترک رخ میدهند. به عنوان مثال: Zn + 2HCl = ZnCl2 + H2
VI. انواع واکنش های شیمیایی بر اساس تغییر در حالت اکسیداسیون مواد واکنش دهنده
- ردوکس (ORR) - واکنش هایی که در آن حالت های اکسیداسیون مواد واکنش دهنده تغییر می کند.
- واکنش هایی در حال وقوع است بدون تغییر حالت اکسیداسیون معرف ها (BISO).

فرآیندهای احتراق و جایگزینی همیشه ردوکس هستند. واکنش های تبادلی بدون تغییر حالت اکسیداسیون مواد رخ می دهد. تمام فرآیندهای دیگر می توانند OVR یا BISO باشند.